Aldo E. Calogero
Dipartimento di Medicina Clinica e Sperimentale, Università di Catania
Negli ultimi tempi si è riscontrato un crescente interesse nello studio del declino età-correlato dei livelli sierici di testosterone nel maschio. Precedentemente questo periodo era stato definito “andropausa”, in analogia a quanto avviene nella donna. L’andropausa tuttavia, intesa come brusca e totale interruzione dell’attività testicolare, in realtà si verifica solo in rarissimi casi, mentre più frequentemente si assiste a un declino dei livelli sierici di testosterone con il passare degli anni. Quando questo declino porta le concentrazioni sieriche di testosterone sotto il limite normale minimo, si parla di ipogonadismo età-correlato (LOH). Questa sindrome è dunque caratterizzata da un declino delle concentrazioni ematiche di androgeni che, sebbene non in maniera così brusca come descritto per i livelli di estrogeni nelle donne che si avvicinano all’età della menopausa, sembra verificarsi in una considerevole quota di uomini nella tarda età.
Molti studi trasversali in letteratura hanno evidenziato come, con l’avanzare degli anni, si assista a un progressivo calo dei livelli di testosterone totale e libero con aumento dell’SHBG, non attribuibile a malattie, farmaci e fumo di sigaretta (1).
Gli studi epidemiologici più importanti hanno ormai chiarito che l’ipogonadismo dell’adulto ha una prevalenza assolutamente ragguardevole:
- il BLSA (Baltimore Longitudinal Studies on Ageing), effettuato su 890 soggetti, dimostrava livelli di testosterone totale < 11 nmol/L (3.2 ng/mL) nel 20% dei 60enni, nel 30% dei 70enni e nel 50% degli 80enni (2);
- il MMAS (Massachusetts Male Aging Study), studio longitudinale condotto su 1677 soggetti di 40-70 anni, riportava ipogonadismo grave (testosterone totale < 6.94 nmol/L – 2 ng/mL) nel 6% dei casi (3);
- il BACHS (Boston Area Community Health Survey), effettuato su 1475 soggetti di 30-79 anni, documentava bassi livelli di testosterone totale (< 10.4 nmol/L – 3 ng/mL) nel 24% dei casi (4);
- l’EMAS (European Male Ageing Study), condotto nel 2010 su 3219 soggetti di 40-79 anni, riportava una prevalenza di ipogonadismo (testosterone totale < 11 nmol/L – 3.2 ng/mL) nel 17% dei casi e di ipogonadismo grave (testosterone totale < 8 nmol/L – 2.3 ng/mL) nel 4% dei casi (5).
Dal punto di vista fisiopatologico, il LOH si caratterizza per un’alterazione nel rilascio pulsatile dell’LH, con picchi ridotti di ampiezza e più frequenti, sebbene la quantità totale secreta e il suo metabolismo non siano significativamente differenti rispetto ai soggetti giovani (6). Inoltre, altri studi hanno evidenziato come nei soggetti anziani i livelli di LH tendono ad aumentare in maniera età-correlata, mentre il numero delle cellule di Leydig si riduce (7,8). A differenza delle ovaie, il testicolo subisce dei cambiamenti con il progredire dell’età ma non va mai incontro a un arresto completo definitivo della propria funzione e la risposta a questo processo fisiologico è estremamente variabile. Si stima che dai 25 agli 80 anni il volume testicolare si riduca di circa il 25% (9).
Dal punto di vista clinico i pazienti con LOH presentano segni e sintomi tipici del deficit androgenico. Al primo posto è riferita la diminuzione del desiderio sessuale, associata in maniera più o meno marcata a disturbi dell’erezione, sia in termini qualitativi (difficoltà nel raggiungimento e/o nel mantenimento dell’erezione, detumescenza precoce, aumento della latenza tra un rapporto ed il successivo) che di frequenza (erezioni spontanee notturne). Seguono le altre manifestazioni della sindrome, le quali non necessariamente sono tutte presenti contemporaneamente: disturbi dell’umore, con concomitante deterioramento delle attività intellettuali, delle funzioni cognitive, dell’abilità all’orientamento nello spazio, fatica, depressione e irritabilità; disturbi del sonno; diminuzione di massa corporea magra, volume muscolare e forza; aumento del grasso viscerale; diminuzione dei peli corporei e alterazioni della cute; diminuzione della densità minerale ossea con conseguente osteopenia e successivamente osteoporosi e aumento del rischio di fratture ossee. Bisogna tuttavia tenere in considerazione quanto spesso i segni e i sintomi sopra-elencati possano comparire in maniera talmente lenta e subdola nel corso degli anni, da far sì che il paziente possa non dare loro il giusto peso, e considerarli come parte di un inevitabile processo di invecchiamento, ritardando così il momento della diagnosi.
Per tali motivi, è importante dedicare tempo ed attenzione alla raccolta dei dati anamnestici, anche con l’ausilio di opportuni questionari, sebbene il loro utilizzo non sia ad oggi raccomandato ai fini diagnostici (8), e all’esame obiettivo. Tra i questionari, possono essere utilizzati:
- l’Aging Male Symptom Score, di cui esiste una versione validata in italiano;
- l’Androgen Deficiency in Aging Men, di cui esiste una versione validata in italiano;
- l’EMAS Sexual Function Questionnaire, di cui non esiste la versione italiana.
Diagnosi
Nel paziente a rischio o nel sospetto di ipogonadismo, è fondamentale il dosaggio di testosterone totale ed SHBG su un campione di sangue prelevato preferibilmente nelle prime ore del mattino (h 8-11), nonostante nel soggetto anziano il ritmo circadiano di secrezione di testosterone sia meno pronunciato.
La valutazione della quota di testosterone libero, utile nei pazienti obesi (nei quali si osserva tipicamente una riduzione dell’SHBG), o nei soggetti sintomatici per deficit androgenico ma con testosteronemia nella norma, può essere calcolata applicando opportune formule che richiedono i valori di testosterone totale, SHBG e albumina.
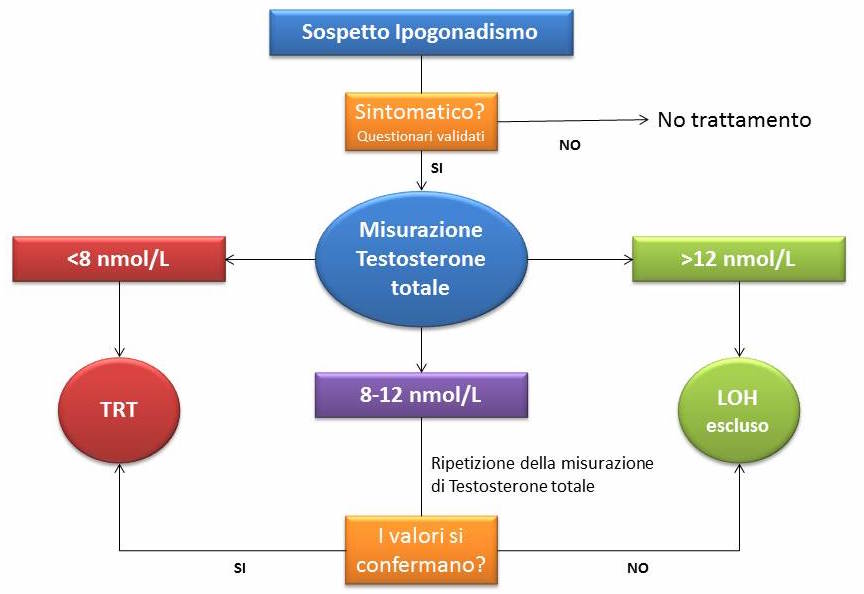
Una delle questioni di più difficile risoluzione è trovare un generale accordo riguardo quali valori di testosteronemia siano inequivocabilmente segno di LOH. Anche se non esiste ancora oggi un valore soglia universalmente accettato, l’orientamento attuale è quello di ritenere patologici i valori di testosterone totale < 8 nmol/L (2.3 ng/mL) e normali quelli superiori a 12 nmol/L (3.5 ng/mL). Ne consegue quindi che per valori compresi tra 8-12 nmol/L, la decisione di prescrivere o meno terapia sostitutiva deve esser presa a seconda dei sintomi riferiti e dei segni clinici raccolti e/o dal riscontro di livelli sierici di testosterone libero inferiori a 180 pmol/L (vedi figura).
Algoritmo diagnostico per l’ipogonadismo età-correlato
Qualora i livelli sierici di testosterone totale risultassero al di sotto del limite inferiore della norma, è consigliabile confermare i risultati con un secondo dosaggio, e misurare anche la concentrazione plasmatica delle gonadotropine ipofisarie (LH e FSH) e della prolattina.
È noto che con l’avanzare dell’età si verificano profonde modificazioni dell’intero sistema endocrino. In particolare, a 70 anni la secrezione spontanea di GH ed IGF-1, come quella di DHEA e del suo pro-ormone solfato DHEAS, risulta già significativamente ridotta rispetto a ciò che si osserva nel giovane. Il significato di tali alterazioni deve essere ancora chiarito. Inoltre, negli ultimi anni, diversi studi hanno identificato un’associazione tra la carenza di vitamina D e bassi livelli di testosterone. La vitamina D, fattore chiave nella regolazione della mineralizzazione ossea e dell’omeostasi del calcio, per svolgere la sua azione deve essere attivata mediante idrossilazione degli atomi di carbonio in posizione 1 e 25. L’isoforma microsomiale del gene CYP2R1, che codifica l’enzima 25-idrossilasi, è espressa ai più alti livelli nelle cellule di Leydig del testicolo e una sua mutazione inattivante risulta in alterazioni del metabolismo del calcio e in una grave deficienza di vitamina D. Ciò indica che le cellule di Leydig svolgono un ruolo di fondamentale importanza nel processo di attivazione della vitamina D. Pertanto, un danno testicolare di qualsivoglia natura comporta un deficit di vitamina D dovuto a una ridotta espressione di quest’enzima. Quindi, gli uomini con ipogonadismo clinico e “subclinico”, con bassi livelli di 25-idrossivitamina D, dovrebbero essere supplementati con vitamina D (9).
Bibliografia essenziale
- Harman SM, Metter EJ, Tobin JD, et al. Longitudinal effects of aging on serum total and free testosterone levels in healthy men. Baltimore Longitudinal Study of Aging. J Clin Endocrinol Metab 2001, 86: 724-31.
- Shock NW, Gruelich RC, Andres RA, et al. Normal human aging. The Baltimore Longitudinal Study of Aging. Washington, DC: US Government Printing Office, 1984.
- Mohr BA, Guay AT, O’Donnell AB, McKinlay JB. Normal, bound and nonbound testosterone levels in normally ageing men: results from the Massachusetts Male Ageing Study. Clin Endocrinol (Oxf) 2005, 62: 64-73.
- Araujo AB, Esche GR, Kupelian V, et al. Prevalence of symptomatic androgen deficiency in men. J Clin Endocrinol Metab 2007, 92: 4241-7.
- Tajar A, Forti G, O’Neill TW, et al; EMAS Group. Characteristics of secondary, primary, and compensated hypogonadism in aging men: evidence from the European Male Ageing Study. J Clin Endocrinol Metab 2010, 95: 1810-8.
- Keenan DM, Veldhuis JD. Disruption of the hypothalamic luteinizing hormone pulsing mechanism in aging men. Am J Physiol Regul Integr Comp Physiol 2001, 281: R1917-24.
- Neaves WB, Johnson L, Porter JC, et al. Leydig cell numbers, daily sperm production, and serum gonadotropin levels in aging men. J Clin Endocrinol Metab 1984, 59: 756-63.
- Huhtaniemi I. Late-onset hypogonadism: current concepts and controversies of pathogenesis, diagnosis and treatment. Asian J Androl 2014, 16: 192-202.
- Foresta C, Calogero AE, Lombardo F, et al. Late-onset hypogonadism: beyond testosterone. Asian J Androl 2015, 17: 236-8.