Fernando Mazzilli, Michele Delfino, Rossella Mazzilli, Francesco Benedetti
Dipartimento di Medicina Clinica e Molecolare, “Sapienza” Università Roma, Unità di Andrologia, AO Sant’Andrea, Roma
ITER DIAGNOSTICO (1-7)
Per un efficace inquadramento, è indispensabile un’accurata anamnesi, per la quale vanno presi in considerazione anche lo stile di vita (fumo, alcol, sostanze stupefacenti, ecc) e l’eventuale utilizzo di farmaci (ad es. steroidi anabolizzanti per attività sportive, anti-ipertensivi, inibitori di pompa protonica, ecc), che possono avere un impatto negativo sulla spermatogenesi e che devono quindi essere corretti.
Lo studio della potenzialità fecondante si basa sull’esame obiettivo (fenotipo, BMI, caratteri sessuali primari e secondari) (fig 1) anche in relazione all’età, ma soprattutto sullo studio seminologico, che deve essere effettuato in centri specialistici, dal momento che a tutt’oggi, malgrado le linee guida del WHO, non vi è ancora una standardizzazione soddisfacente per la valutazione dei parametri seminali, con inevitabili ripercussioni interpretative nella loro valutazione.
Figura 1. Orchidometro di Prader per la determinazione volumetrica testicolare
A. Indagini di laboratorio
A.1. Esame standard del liquido seminale e diagnostica differenziale seminologica (8-14)
L’esame seminale deve essere eseguito almeno 2 volte, a distanza di 3 mesi l’uno dall’altro, per evitare indicazioni insufficienti dovute alla variabilità dei parametri seminali.
| Tabella 1 Terminologia (in relazione al 5° centile) e diagnostica seminologica |
|||
| Parametri | Definizioni | Indicazioni diagnostiche | |
| Normospermia: normalità di tutti i parametri seminali | |||
| Aspetto | Acquoso | Scarsa componente cellulare | |
| Torbido | Flogosi | ||
| Torbido ematico | Emospermia | ||
| Volume | Aspermia (assenza di eiaculato) | Ipogonadismo, fattori psicogeni, eiaculazione retrograda, ostruzione del tratto terminale delle vie seminali | |
| Ipospermia o ipoposia (volume ridotto) | Ostruzione dei dotti eiaculatori (con pH acido per la pressoché esclusiva componente prostatica), ipogonadismo | ||
| Iperspermia o polispermia (> 6 mL) | Flogosi delle ghiandole accessorie del tratto genitale (MAGI) | ||
| pH | Acido | Ostruzione dei dotti eiaculatori (con azoospermia e ipoposia) | |
| Viscosità | Aumentata | MAGI; espressione minima di Fibrosi Cistica | |
| Concentrazione nemaspermica | Normozoospermia (≥ 15 x 106/mL): normale concentrazione nemaspermica | ||
| Oligozoospermia (< 15 x 106/mL) | Di grado lieve-medio (5-15 x 106/mL): lifestyle (fumo, alcol, distress), varicocele, MAGI, criptorchidismo, disordini endocrini e metabolici (diabete mellito), stress ossidativo, presenza di anticorpi anti-spermatozoo. Di grado severo (< 5 x 106/mL): oltre alle precedenti, è dovuta a anomalie genetiche, esiti di orchiti, traumi, chemio/radioterapia, ecc. |
||
| Criptozoospermia (presenza di spermatozoi solo dopo centrifugazione) | Come nell’oligozoospermia di grado elevato | ||
| Azoospermia (assenza di spermatozoi nell’eiaculato) | Secretoria | Ipogonadismo ipogonadotropo, ipotalamico o ipofisario (con LH e FSH ridotti e ipotestosteronemia): s. di Kallmann, ecc. Danno tubulare con FSH elevato e normali LH e testosterone: esiti di traumi, neoplasie, chemio/radioterapie, orchiti, ecc. Ipogonadismo ipergonadotropo (con ipotestosteronemia e con LH e FSH elevati): oltre alle precedenti da danno tubulare, disordini congeniti con o senza alterazione del cariotipo, quali s. di Klinefelter, s. a sole cellule del Sertoli, arresti maturativi, ecc. Insensibilità recettoriale agli androgeni (con testosterone e gonadotropine elevati). |
|
| Escretoria (o ostruttiva) | Ostruzioni delle vie seminali di natura congenita (fibrosi cistica) o acquisita (esiti di infezioni retrograde); il profilo ormonale è nei limiti | ||
| Motilità | Normocinesia (PR ≥ 32% o PR + NP ≥ 40%): normale motilità nemaspermica | ||
| Ipocinesia/discinesia (o astenozoospermia)(PR < 32% o PR + NP < 40%) | Di grado lieve-medio (PR 5-32%): come nell’oligozoospermia di grado lieve-medio. Di grado severo (< 5%): come nell’oligozoospermia di grado severo. |
||
| Acinesia (assenza di motilità) | Come nell’ipocinesia/discinesia di grado elevato; inoltre presenza di spermatozoi a code mozze o sindrome delle ciglia immobili nell’ambito della s. di Kartagener | ||
| Morfologia | Teratozoospermia (atipie > 96%) | Come nell’oligozoospermia e nell’astenozoospermia di grado severo; inoltre, nelle forme genetiche monosomiche (teste a palla o round head sperm; spermatozoi a code mozze) | |
| Oligoastenoteratozoospermia: alterazione del numero, della motilità e della morfologia nemaspermica | |||
| Altro | Globuli bianchi aumentati (> 1 x 106/mL) | Flogosi/infezioni | |
| Zone di spermio-agglutinazione | Flogosi, presenza di anticorpi anti-spermatozoo | ||
Alcuni autori hanno proposto delle particolari formule matematiche con l’elaborazione di un “indice di fertilità”. Attualmente questi indici sono in disuso, dal momento che non forniscono indicazioni cliniche valide. Sempre a tal riguardo, è stato recentemente proposto come indicatore del fattore maschile nell’infertilità la “concentrazione totale di spermatozoi mobili o Total Motile Sperm Count (TMSC), che si ottiene moltiplicando il numero totale/eiaculato per la percentuale di motilità progressiva. La suddivisione in 5 classi (a seconda del TMSC) determina il grado di potenzialità fecondante (13):
- gruppo 1: TMSC < 1 × 106;
- gruppo 2: TMSC 1–5 × 106;
- gruppo 3: TMSC 5–10 × 106;
- gruppo 4: TMSC 10–20 × 106;
- gruppo 5: TMSC >20 × 106 (considerato normale).
Situazioni particolari
Nell’eiaculazione retrograda in vescica urinaria, dovuta a pregressi interventi chirurgici in ambito pelvico, a neuropatie, o a farmaci, la diagnosi si basa sull’evidenziazione di spermatozoi in urine post-orgasmiche (vedi tecniche di PMA).
Microscopia Elettronica a Trasmissione (TEM) (15-17)
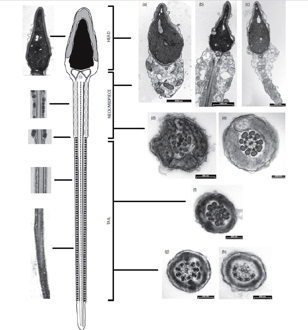
In supporto alla microscopia ottica, lo studio TEM offre dettagli strutturali che possono essere dirimenti nella diagnosi differenziale tra acinesia/ipocinesia nemaspermica su base genetica e strutturale o metabolica. Infatti, la TEM si rivela particolarmente utile nella definizione morfologica dell’assonema, evidenziandone le anomalie dei micro-tubuli, che possono essere di tipo morfo-ultrastrutturale o di ordine numerico, con configurazioni variabili, quali 9+2 e 9+0 (meno frequenti)(fig 2).
Figura 2. Microscopia Elettronica a Trasmissione (TEM). A sinistra: normale aspetto ultrastrutturale dello spermatozoo umano. A destra: esempi di alterazioni della testa (a-c), del tratto intermedio (d,e) e della coda (f-h).
In: Visco V, Raffa S, Elia J, Delfino M, Imbrogno N, Torrisi MR, Mazzilli F. Morphological sperm defects analyzed by light microscopy and transmission electron microscopy and their correlation with sperm motility. Int J Urol 2010, 17: 259-66.
Biochimica seminale (14,18)
Il plasma seminale rappresenta il prodotto di secrezione del testicolo (10-15% dell’eiaculato), delle vescicole seminali (65-70%) e della prostata (20-25%). Alcune sostanze sono filtrate dal sangue a vari livelli del tratto genitale; altre sono invece sintetizzate o filtrate selettivamente in un determinato distretto e quindi rappresentano degli indici specifici per ciascun distretto. Pertanto, le determinazioni dell’alfa-glicosidasi e della L-Carnitina (indici epididimari), del fruttosio (indice vescicolare) e dell’acido citrico (indice prostatico) possono essere utilizzate per la diagnosi differenziale tra azoospermie secretorie ed escretorie e della sede dell’eventuale ostruzione.
| Tabella 2 Diagnostica differenziale delle azoospermie in base agli indici biochimici e al pH |
||||
| pH | Indici biochimici | |||
| Carnitina | Fruttosio | Acido citrico | ||
| Azoospermia secretiva con normale testosteronemia | Normale | Normale | Normale | Normale |
| Azoospermia secretiva con ipotestosteronemia | Normale | Ridotta | Normale/Ridotto | Ridotto |
| Azoospermia ostruttiva intra-epididimaria o dei dotti deferenti | Normale | Ridotta | Normale | Normale |
| Azoospermia ostruttiva dei dotti eiaculatori | Acido | Ridotta/indosabile | Ridotto/indosabile | Aumentato |
Test biologici e funzionali sullo spermatozoo (15,19-20)
Vi sono essenzialmente due tipologie di test.
Test che mimano in vitro le tappe principali dell’attività funzionale dello spermatozoo che si verificano dopo l’eiaculazione. Tra questi:
- swim-up, ossia test di separazione dal plasma seminale e recupero di spermatozoi mobili in media sostitutivi del plasma seminale (vedi applicazione in PMA);
- test di penetrazione nemaspermica in vitro in muco cervicale (vedi diagnosi infertilità di coppia);
- induzione della motilità iperattivata.
Test di resistenza dello spermatozoo a stress fisici, termici e chimici e quindi una valutazione degli eventuali errori maturativi nel processo spermatogenetico.Tra questi:
- swelling test o test di rigonfiamento nemaspermico in ambiente ipo-osmotico (valori normali WHO 2010: ≥ 58% spermatozoi rigonfi);
- test di frammentazione del DNA (che si esprimono in percentuale di spermatozoi con frammentazione):
- TUNEL test (terminal deoxynucleotidyl transferase–mediated fluorescein–dUTP nick end labeling): permette di evidenziare rotture singole o doppie nel filamento del DNA;
- test all’arancio di acridina (Acridine Orange Test – AO): valuta le condizioni di resistenza della cromatina spermatica all’azione di agenti denaturanti;
- altri test: Sperm Chromatin Structure Assay (SCSA); Single Cell Gel Electrophoresis assay (COMET), Sperm Chromatin Dispersion Test (SCD test – Halosperm); In Situ Nick Translation (ISNT);
- test di crio-conservazione del seme in azoto liquido a -196°C, che evidenzia il recupero di spermatozoi mobili dopo congelamento/scongelamento;
- Fluorescence In Situ Hybridization (FISH) per l’evidenziazione di aneuploidie spermatiche.
Test immunologici (21)
La ricerca di anticorpi anti-spermatozoo può essere eseguita mediante:
- metodiche indirette, atte a valutare l’attività biologica degli anticorpi circolanti. Tra queste: Gelatin Agglutination Test (GAT) e Tray Agglutination Test (TAT);
- metodiche dirette, in grado di valutare la presenza di anticorpi direttamente adesi alla superficie dello spermatozoo. Tra queste: Mixed Antiglobulin Reaction (MAR) Test diretto e Immunobead Test (IBT).
Altri test
I test sopra descritti non consentono di utilizzare gli spermatozoi testati nelle tecniche di PMA. Per questo motivo sono state proposte, soprattutto per i casi di teratozoospermia di grado severo, tecniche non invasive in grado di selezionare spermatozoi con maggiore potenzialità fecondante, per poi utilizzarli direttamente per la PMA:
- Magnetic Activated Cell Sorting (MACS): servirebbe a bloccare spermatozoi in necrosi o in fase avviata di apoptosi;
- birifrangenza: selezione basata sulla proprietà di birifrangenza dello spermatozoo funzionalmente integro, evidenziabile con microscopio invertito con luce polarizzata;
- Motile Sperm Organelle Morphology Examination (MSOME): selezione basata sull’utilizzazione di un microscopio invertito ad alta risoluzione (fino ad oltre 6000x), che permette di utilizzare la cosiddetta Intracytoplasmic Morphologically-Selected Sperm Injection (IMSI).
Si tratta però di metodiche che hanno tuttora bisogno di una verifica di applicabilità su larga scala.
A.2. Profilo ormonale (22-24)
Lo studio del profilo ormonale è fondamentale per valutare la presenza di un disordine endocrino e per avere indicazioni valide sull’entità del danno testicolare e sulle possibilità di recupero della funzione spermatogenetica.
Lo studio ormonale di base comprende il dosaggio delle gonadotropine (FSH e LH) e del testosterone totale (il prelievo venoso per il dosaggio di questo, data la sua variazione circadiana, va effettuato nelle prime ore della mattina). Il dosaggio del testosterone totale può essere integrato dalla valutazione della quota libera (testosterone libero, F-T), che viene effettuata mediante un’equazione tra testosterone totale, albumina e SHBG, poiché il dosaggio diretto con dialisi dell’equilibrio o con la precipitazione con ammonio non è ancora ampiamente disponibile o attendibile.
Patologie pre-testicolari: vi sono ridotti livelli di gonadotropine e di testosterone. In questi casi è ovviamente indicato valutare gli altri ormoni ipofisari per una diagnosi differenziale tra deficit selettivo della secrezione gonadotropinica e panipopituitarismo. Il test al GnRH è utile per differenziare le forme ipofisarie da quelle ipotalamiche. Utile associare indagini genetiche (gene Kal1 per individuare la s. di Kallmann).
Patologie testicolari:
- nelle forme di ipogonadismo con fattore eziopatogenetico ben identificabile (congenito o acquisito), vi sono elevati livelli di gonadotropine e ridotti livelli di testosterone;
- nelle patologie selettive della componente tubulare, con dispermia severa, vi è FSH elevato con normali valori di LH e testosterone;
- nelle dispermie di grado lieve-medio, i valori di FSH, LH e testosterone sono generalmente nei limiti della norma. Questo quadro riguarda tutte quelle condizioni patologiche che non rappresentano un fattore patogenetico certo ed esclusivo; tra queste le più frequenti sono rappresentate dal varicocele e dalle flogosi del tratto genitale.
Una menzione a parte merita l’inibina B, che è secreta nell’uomo dalle cellule del Sertoli e che ha un’azione inibitoria sulla secrezione di FSH. In realtà è poco utilizzata nella diagnostica andrologica, ma il suo dosaggio potrebbe essere utile come marcatore di spermatogenesi attiva. In particolare, un livello molto basso di inibina B indicherebbe una mancata produzione di spermatozoi e quindi sconsiglierebbe di procedere con prelievo intra-testicolare (TESE).
Patologie post-testicolari (14): i valori di gonadotropine e testosterone sono nel range di normalità. Utile lo studio biochimico del plasma seminale (vedi sopra).
Patologie endocrine extra-gonadiche: come esami di seconda fascia, sulla base dei dati clinico-anamnestici e dei dati laboratoristici di base, può essere indicato lo studio della funzione tiroidea, il dosaggio della PRL, dell’estradiolo (E2), degli altri ormoni ipofisari (ACTH nei casi di s. adreno-genitale, ecc.) e del profilo metabolico (diabete mellito). Recentemente è stato ipotizzato che anche una carenza di vitamina D potrebbe avere un impatto negativo sui parametri seminali.
A.3. Infezioni e flogosi (25-28)
Le infezioni più frequenti a carico del tratto genitale maschile sono dovute a germi comuni, Chlamydia Trachomatis e Mycoplasma. Per quanto riguarda specificamente i germi comuni, al contrario delle infezioni urinarie, sono più frequenti i batteri Gram-positivi (Enterococco e Streptococco Viridans) rispetto ai Gram-negativi (Escherichia Coli, Proteus Vulgaris, Proteus Mirabilis). Meno frequente è l’infezione da Neisseria Gonorrhoeae, che, se non trattata adeguatamente, può determinare ostruzione delle vie seminali. Per quanto riguarda i virus, è stata più volte segnalata la possibilità di dispermia da infezione HIV; recentemente è stata segnalata l’importanza, anche nell’uomo, delle infezioni da HPV. Per l’accesso a tecniche di PMA, infine, il pannello prevede anche lo studio dell’epatite B e C e della sifilide.
Lo studio infettivologico viene effettuato mediante:
- prelievo ematico per anticorpi anti-HIV, epatite B e C, sifilide, citomegalovirus, herpes virus;
- liquido seminale (spermiocoltura) per germi comuni, miceti, HPV; Trichomonas a fresco;
- tampone uretrale per germi comuni, N. Gonorrhoeae, C. Trachomatis, Mycoplasma, HPV.
A.4. Indagini genetiche (29-32)
Le indagini genetiche, da un punto di vista diagnostico, sono essenziali in casi di: oligozoo-asteno-teratozoospermia di grado severo, di criptozoospermia o di azoospermia. Le indagini più importanti per il partner maschile sono rappresentate da:
- cariotipo, che permette di evidenziare alterazioni dei cromosomi sessuali (di cui la più frequente è la s. di Klinefelter) o di quelli autosomici (traslocazioni, ecc);
- ricerca di microdelezioni del cromosoma Y (in corrispondenza della regione eucromatica, dove si trova il “fattore azoospermico” AZF);
- ricerca di mutazioni del gene CFTR (Fibrosi Cistica), responsabili di una condizione di agenesia dei deferenti o dei dotti eiaculatori (Congenital Bilateral Absence of Vas Deferens – CBAVD), con conseguente quadro di azoospermia ostruttiva.
Queste stesse indagini vengono comunque eseguite per l’ingresso in programmi di PMA.
Nei casi di ipogonadismo ipogonadotropo, può essere indicato lo studio del gene Kal1.
Per quanto riguarda le malattie genetiche trasmissibili, non direttamente collegate con la funzione riproduttiva, il pannello “minimo” prevede l’elettroforesi dell’emoglobina (per la microcitemia) e la Glucosio-6-Fosfato-Deidrogenasi (G6PD).
B. Indagini strumentali (33-37)
B.1. Ecografia scrotale
B.2. Ecografia prostatica e vescicolare per via trans-rettale
Questo esame, eseguibile con sonda trans-rettale, consente di verificare le dimensioni e la morfologia delle ghiandole accessorie del tratto genitale (prostata e vescicole seminali, che contribuiscono per circa l’85% alla formazione del plasma seminale). Consente quindi di evidenziare una condizione di prostato-vescicolite, con inevitabili conseguenze negative sulla qualità dell’eiaculato.
B.3. Ago-aspirato testicolare
L’ago-aspirato testicolare (TESA – TEsticular Sperm Aspiration) è una procedura di rapida esecuzione e minimamente invasiva. Può essere effettuata in soggetti con sospetta azoospermia ostruttiva a scopo diagnostico (ricerca spermatozoi maturi o cellule immature come spermatogoni, spermatociti primari e secondari, spermatidi, o cellule del Sertoli) e terapeutico, utilizzando cioè gli eventuali spermatozoi recuperati per tecniche di PMA. Un’alternativa è l’ago-aspirato epididimario (MESA – Microsurgical Epididymal Sperm Aspiration).
B.4. Biopsia testicolare
La biopsia testicolare (TESE – Testicular Sperm Extraction) rappresenta una procedura finalizzata al prelievo e alla crio-conservazione di spermatozoi recuperati in pazienti azoospermici. L’esame istologico può mostrare un quadro di spermatogenesi conservata (indicativo di azoospermia post-testicolare), un’alterata spermatogenesi o un arresto della linea spermatogenetica. Una procedura avanzata è quella della Micro-TESE, che prevede anche l’utilizzo di un microscopio durante la procedura.
B.5. Deferento-vescicolografia
È un esame radiologico utilizzato per la diagnosi differenziale tra azoospermia secretoria ed escretoria. Valuta cioè morfologia e pervietà intra-luminale delle vie seminali extra-testicolari: deferenti, vescicole seminali, ampolle deferenziali e dotti eiaculatori. È quasi in disuso per due motivi: falsi positivi e negativi a livello epididimario; sviluppo delle tecniche di prelievo di spermatozoi direttamente dal testicolo o dall’epididimo. È inoltre un esame cruento, in quanto il deferente deve essere isolato chirurgicamente e bisogna inserire un ago nel suo lume.
B.6. Risonanza magnetica dell’ipofisi (23)
Questa indagine risulta utile nei casi di ipogonadismo ipogonadotropo, per escludere la presenza di lesioni ipotalamo-ipofisarie.
BIBLIOGRAFIA
- Foresta C (coordinatore), et al. Infertilità maschile. Fisiopatologia, clinica, diagnostica e terapia. Coop. Libraria Editrice, Università di Padova, 2009.
- Jungwirth A, Diemer T, Dohle GR, et al. Guidelines on male infertility. European Association of Urology 2015.
- National Institute for Health and Clinical Excellence: Guidance (NICE). Fertility: assessment and treatment for people with fertility problems. London: Royal College of Obstetricians & Gynaecologists, 2013.
- Nieschlag E, Lenzi A. The conventional management of male infertility. Int J Gynaecol Obstet 2013, 123: S31-5.
- Sikka SC, Hellstrom WJ. Current updates on laboratory techniques for the diagnosis of male reproductive failure. Asian J Androl 2016, 18: 392-401.
- Foresta C, Garolla A, Frigo AC, et al. Anthropometric, penile and testis measures in post-pubertal Italian males. J Endocrinol Invest 2013, 36: 287-92.
- Huijgen NA, de Ridder MA, Verhamme KM, et al. Are proton-pump inhibitors harmful for the semen quality of men in couples who are planning pregnancy? Fertil Steril 2016, doi: 10.1016/j.fertnstert.2016.09.010.
- World Health Organization. Laboratory manual for the examination and processing of human semen. 5th ed. New York: Cambridge University Press, 2010.
- Mazzilli F. Il liquido seminale umano: aspetti laboratoristici, epidemiologici e diagnostici. Il patologo clinico 1987, 4: 1-22.
- Gandini L (coordinatore), et al. Atlante di seminologia. Carocci Ed. 2004.
- Gandini L, Lenzi A. Biotecnologie della riproduzione umana. Carocci Ed. 2013.
- Mazzilli F, Rossi T, Delfino M, et al. Application of the upgraded image superimposition system (SIAS) to the assessment of sperm kinematics. Andrologia 1999, 31: 187-94.
- Hamilton JA, Cissen M, Brandes M, et al. Total motile sperm count: a better indicator for the severity of male factor infertility than the WHO sperm classification system. Hum Reprod 2015, 30: 1110-21.
- AUA best practice statement. The evaluation of the azoospermic male. American Urological Association. 2010.
- Moretti E, Baccetti B, Capitani S, et al. Necrosis in human spermatozoa. II. Ultrastructural features and FISH study in semen from patients with recovered uro-genital infections. J Submicrosc Cytol Pathol 2005, 37: 93-8.
- Francavilla S, Pelliccione F, Cordeschi G, et al. Ultrastructural analysis of asthenozoospermic ejaculates in the era of assisted procreation. Fertil Steril 2006, 85: 940-6.
- Visco V, Raffa S, Elia J, et al. Morphological sperm defects analyzed by light microscopy and transmission electron microscopy and their correlation with sperm motility. Int J Urol 2010, 17: 259-66.
- Mazzilli F, Rossi T, Delfino M, et al. Azoospermia: incidence, and biochemical evaluation of seminal plasma by the differential pH method. Panminerva Med 2000, 42: 27-31.
- Muratori M, Marchiani S, Tamburrino L, et al. DNA fragmentation in brighter sperm predicts male fertility independently from age and semen parameters. Fertil Steril 2015, 104: 582-90.e4.
- Cui ZL, Zheng DZ, Liu YH, et al. Diagnostic accuracies of the TUNEL, SCD, and Comet based sperm DNA fragmentation assays for male infertility: a meta-analysis study. Clin Lab 2015, 61: 525-35.
- Lombardo F, Gandini L, Dondero F, et al. Antisperm immunity in natural and assisted reproduction. Hum Reprod Update 2001, 7: 450-6.
- Radicioni AF, Ferlin A, Balercia G, et al. Consensus statement on diagnosis and clinical management of Klinefelter syndrome. J EndocrinolInvest 2010, 33: 839-50.
- Boehm U, Bouloux PM, Dattani MT, et al. Expert consensus document: European Consensus Statement on congenital hypogonadotropic hypogonadism–pathogenesis, diagnosis and treatment. Nat Rev Endocrinol 2015, 11: 547-64.
- Kathrins M, Niederberger C. Diagnosis and treatment of infertility-related male hormonal dysfunction. Nat Rev Urol 2016, 13: 309–23.
- La Vignera S, Condorelli RA, Vicari E, et al. Microbiological investigation in male infertility: a practical overview. J Med Microbiol 2014, 63: 1-14.
- Foresta C, Noventa M, De Toni L, et al. HPV-DNA sperm infection and infertility: from a systematic literature review to a possible clinical management proposal. Andrology 2015, 3: 163-73.
- Dondero F, Rossi T, D’Offizi G, et al. Semen analysis in HIV seropositive men and in subjects at high risk for HIV infection. Hum Reprod 1996, 11: 765-8.
- Garolla A, Pizzol D, Bertoldo A, et al. Sperm viral infection and male infertility: focus on HBV, HCV, HIV, HPV, HSV, HCMV, and AAV. J Reprod Immunol 2013, 100: 20-9.
- Krausz C, Escamilla AR, Chianese C. Genetics of male infertility: from research to clinic. Reproduction 2015, 150: R159-74.
- Pizzol D, Ferlin A, Garolla A, et al. Genetic and molecular diagnostics of male infertility in the clinical practice. Front Biosci (Landmark Ed) 2014, 19: 291-303.
- Krausz C, Hoefsloot L, Simoni M, et al. European Molecular Genetics Quality Network. EAA/EMQN best practice guidelines for molecular diagnosis of Y-chromosomal microdeletions: state-of-the-art 2013. Andrology 2014, 2: 5-19.
- Elia J, Mazzilli R, Delfino M, et al. Impact of Cystic Fibrosis Transmembrane Regulator (CFTR) gene mutations on male infertility. Arch Ital Urol Androl 2014, 86: 171-4.
- Isidori AM, Lenzi A. Scrotal ultrasound: morphological and functional atlas. Forum Service editore srl, 2008.
- Sarteschi LM, Marchini Fabris GF. Ecografia andrologica. Athena srl, 2003.
- Mazzilli F, Delfino M, Imbrogno N, et al. Seminal profile of subjects with testicular microlithiasis and testicular calcifications. Fertil Steril 2005, 84: 243-5.
- Shridharani A, Owen RC, Elkelany OO, et al. The significance of clinical practice guidelines on adult varicocele detection and management. Asian J Androl 2016, 18: 269-75.
- Lotti F, Maggi M. Ultrasound of the male genital tract in relation to male reproductive health. Hum Reprod Update 2015, 21: 56-83.