Vincenzo Favilla, Daniele Urzì, Giulio Reale
UOC Urologia, AOU “Policlinico-Vittorio Emanuele”, Università di Catania
Generalmente un tumore testicolare si presenta come nodulo duro o tumefazione indolente della gonade, spesso riscontrata dallo stesso paziente mediante auto-palpazione. In altri casi la manifestazione clinica può essere la sensazione di peso o tensione scrotale e solo nel 10% dei casi una sintomatologia algica simil-orchitica. Sempre più frequente, grazie alla diffusione della diagnostica per immagini, è il riscontro di lesioni testicolari incidentali e asintomatiche in corso di ecografia scrotale eseguita per altre motivazioni, come screening andrologico, infertilità, varicocele, ecc. Nei casi più avanzati, per fortuna sempre di minor osservazione, il quadro clinico può essere quello di malattia già metastatica (linfoadenopatie sovra-claveari, tosse per interessamento polmonare, disturbi gastro-intestinali, dolori dorso-lombari secondari a malattia retro-peritoneale o metastasi ossee, perdita di peso, malessere generale). Raramente la diagnosi viene posta dopo la comparsa di sindromi paraneoplastiche, come la ginecomastia da iperincrezione di ormoni sessuali, specialmente secondari a tumori testicolari a cellule del Leydig.
La valutazione clinica deve comprendere la storia anamnestica del paziente, volta a indagare eventuali fattori di rischio per neoplasia testicolare, quali familiarità, criptorchidismo, infertilità, esposizione a inquinanti ambientali (anche se il ruolo di questi ultimi nell’eziopatogenesi non risulta ancora completamente ben definito).
L’esame obiettivo dei genitali, con l’ispezione e la palpazione dei testicoli, permetterà in molti casi clinicamente apprezzabili di porre una diagnosi differenziale con altre affezioni benigne, quali orchiti ed epididimiti, idrocele (quest’ultimo trans-illuminabile a differenza delle masse solide), ernie inguino-scrotali, varicocele. In caso di masse testicolari voluminose, il testicolo interessato si potrà presentare aumentato di volume e alla palpazione tipicamente la massa testicolare si presenterà di consistenza aumentata rispetto al parenchima circostante. Pertanto, qualsiasi area solida, di consistenza dura all’interno della tunica albuginea dovrebbe essere considerata sospetta e meritevole di approfondimento diagnostico. L’esame obiettivo del testicolo, non deve essere mai disgiunto da un esame fisico generale, al fine di escludere metastasi a distanza a livello delle stazioni linfonodali sovra-claveari, masse addominali palpabili e ginecomastia. Spesso tuttavia, specie in fase precoce o in presenza di piccole lesioni testicolari intra-parenchimali, l’obiettività clinica potrà risultare assolutamente negativa; al tempo stesso la presenza di un eventuale idrocele contestuale, rendendo la palpazione del didimo difficoltosa, potrà celare un’eventuale lesione testicolare.
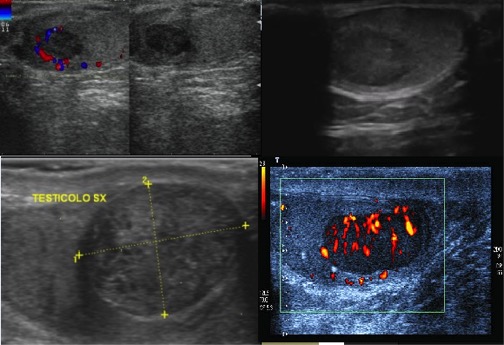
L’ecografia scrotale risulta pertanto l’esame indispensabile per porre diagnosi di lesione testicolare e per consentire al tempo stesso una diagnosi differenziale con altre affezioni testicolari, quali orchi-epididimite, idrocele, torsione del funicolo spermatico. L’indagine ecografica presenta valori di sensibilità prossimi al 100%; inoltre il basso costo e la ripetibilità dell’esame rendono tale metodica estremamente diffusa. Tipicamente un tumore testicolare all’ecografia si presenterà nella maggior parte dei casi come una lesione nodulare singola o multipla, ipoecogena rispetto al parenchima sano e spesso a margini ben delimitati o debolmente sfumati. Occasionalmente queste lesioni, quando voluminose, potranno interessare l’intero parenchima testicolare o presentare al loro interno aree cistiche di natura necrotica o emorragica; inoltre, frequentemente all’indagine ecocolor-doppler saranno ipervascolarizzate (figura 1).
Figura 1. Quadri ecografici di neoformazioni testicolari
Altra valutazione fortemente raccomandata in presenza di lesione testicolare è la valutazione dei marcatori tumorali sierici, estremamente utili non solo nella diagnosi, ma anche nel follow-up e nel monitoraggio clinico del paziente. I più importanti sono la ß-hCG, l’alfa-fetoproteina (α-FP) e l’LDH. La ß-hCG è una glicoproteina prodotta dalle cellule del sincizio-trofoblasto, con emivita plasmatica di circa 24-36 h, che risulta elevata in presenza di coriocarcinoma, carcinoma embrionale, teratomi e nel 30% circa dei seminomi. L’α-FP, invece, viene prodotta dalle cellule del seno endodermico, ha emivita plasmatica di 4-6 giorni e può risultare elevata nei tumori del sacco vitellino, nel carcinoma embrionale e nel teratocarcinoma; non è mai stata riscontrata elevata nei seminomi e nei coriocarcinomi che non fossero associati ad altri istotipi di neoplasia. Può essere elevata anche in altre neoplasie come l’epatocarcinoma, i tumori polmonari e pancreatici, come pure in alcune epatopatie benigne. Un altro marcatore più aspecifico è rappresentato dall’LDH, enzima presente in molti tessuti dell’organismo e di cui si conoscono 5 isoenzimi differenti: l’isoenzima 1 è aumentato nei tumori non seminomatosi del testicolo e la sua concentrazione correla con il volume e la proliferazione cellulare, rappresentando un indice prognostico, oltre che avere una certa utilità in fase diagnostica e nel follow-up.
I marcatori tumorali devono essere rivalutati prima e dopo orchifunicolectomia, per determinare la cinetica di dimezzamento, e sono di grande utilità prima dell’inizio di un eventuale trattamento chemioterapico in caso di malattia metastatica, per classificare il paziente nella stratificazione di rischio dell’International Germ Cell Cancer Collaborative Group (IGCCCG) (1). La persistenza di marcatori tumorali sierici elevati dopo orchiectomia potrebbe indicare, infatti, la presenza di malattia metastatica (macro- o microscopicamente). Inoltre, in corso di chemioterapia, gli indicatori sierici dovrebbero diminuire e dunque la persistenza di valori elevati assume significato prognostico negativo (2,3). Tuttavia, va ricordato che, in caso di lesione testicolare, la presenza di marcatori sierici negativi non esclude la malignità della neoplasia e pertanto è sempre indicata nei casi dubbi l’esplorazione chirurgica con eventuale biopsia e orchifuniculectomia, in caso di positività neoplastica all’esame istologico estemporaneo intra-operatorio.
Una volta accertata la diagnosi di neoplasia, la stadiazione deve essere completata con la TC del torace, dell’addome e della pelvi con e senza mdc, per valutare un eventuale coinvolgimento metastatico delle stazioni linfonodali retro-peritoneali, del parenchima polmonare e degli organi addominali (figura 2).
Figura 2. Metastasi linfonodali retro-peritoneaii
In caso di controindicazione al mezzo di contrasto per ipersensibilità o alterazione degli indici di funzionalità renale, un possibile ausilio diagnostico alternativo è rappresentato dalla RMN, tuttavia gli elevati costi ne limitano le applicazioni cliniche (4,5). Nello studio delle stazioni linfonodali retro-peritoneali bisogna tenere conto delle aree di metastatizzazione dei tumori testicolari, definite da studi anatomici e chirurgici:
- testicolo sinistro: l’area di drenaggio è l’area para-aortica sinistra, delimitata medialmente dall’aorta, cranialmente dall’arteria renale, lateralmente dall’uretere sinistro, posteriormente dal muscolo psoas e inferiormente dall’incrocio dell’uretere con l’arteria iliaca comune omolaterale;
- testicolo destro: l’area di drenaggio è più ampia e interessa l’area para-aortica destra e l’area iliaca comune destra, includendo al suo interno la vena cava inferiore; tale area è delimitata medialmente dall’aorta, cranialmente dall’arteria renale destra, lateralmente dall’uretere destro, posteriormente dal muscolo psoas e inferiormente da una linea che passa attraverso la biforcazione iliaca comune.
Non esistono attualmente evidenze scientifiche che avvalorino l’utilizzo della PET con fluoro-deossiglucosio (FDG-PET) nella stadiazione del cancro del testicolo (6-11). La scintigrafia ossea e la TC encefalo vengono invece raccomandate solo in casi selezionati, in particolare in pazienti che presentino dolori ossei o sintomi neurologici che possano giustificare localizzazioni metastatiche in queste sedi.
Una volta eseguiti gli accertamenti, è possibile classificare la neoplasia secondo il sistema TNM 2009, raccomandato dalle linee guida della Società Europea di Urologia (12), che tiene conto dell’estensione locale della neoplasia (T), dell’interessamento dei linfonodi regionali (N), della presenza e/o assenza di metastasi a distanza (M), nonché dei livelli sierici dei marcatori tumorali hCG, aFP e LDH dopo orchiectomia (S) (tabella 1).
| Tabella 1 Stadiazione TNM dei tumori testicolari (sec UICC 2009 7° edizione) |
||
| T | pTx | Tumore primitivo non definibile |
| pT0 | Tumore primitivo non evidenziabile | |
| pTis | Carcinoma in situ o neoplasia intra-epiteliale (TIN) | |
| pT1 | Tumore limitato a testicolo ed epididimo senza invasione linfo-vascolare | |
| pT2 | Tumore limitato a testicolo ed epididimo con invasione linfo-vascolare o tumore che si estende attraverso la tunica albuginea | |
| pT3 | Tumore che ha invaso il funicolo spermatico | |
| pT4 | Tumore che ha invaso lo scroto | |
| N | Nx | Linfonodi regionali non valutabili |
| N0 | Linfonodi regionali liberi da metastasi | |
| N1 | Metastasi linfonodali di dimensioni massime ≤ 2 cm | |
| N2 | Metastasi linfonodali di dimensioni 2-5 cm | |
| N3 | Metastasi con massa linfonodale > 5 cm | |
| M | M0 | Assenza di metastasi a distanza |
| M1a | Metastasi in linfonodi non regionali (torace, collo) o metastasi polmonari | |
| M1b | Metastasi in altri organi (fegato, cervello, ossa) | |
| S | Sx | Dosaggi marcatori serici non disponibili o non eseguiti |
| S0 | Dosaggi marcatori serici nei limiti di norma | |
| S1-3 | Dosaggi marcatori serici da leggermente a molto elevati | |
Infine nel 1997 l’International Germ Cell Cancer Collaborative Group (IGCCCG) ha messo a punto un sistema di stadiazione basato sulla prognosi dei pazienti, che è stato incorporato nella classificazione TNM. Secondo questa classificazione, i pazienti con neoplasie seminomatose e non seminomatose (NSGCT) sono stratificati in prognosi buona, intermedia e cattiva sulla base del TNM, della sede del tumore primitivo, delle metastasi e in relazione ai livelli dei marcatori tumorali sierici. Questa classificazione ha un ruolo essenziale nella programmazione dell’iter terapeutico dopo orchifuniculectomia (tabella 2).
| Tabella 2 Stratificazione prognostica (sec IGCCCG) |
||
| Prognosi | Non seminoma | Seminoma |
| Buona | Criteri (tutti inclusi):
A 5 anni: PFS 89%, OS 92% |
Criteri (tutti inclusi):
A 5 anni: DFS 82%, OS 86% |
| Intermedia | Criteri (tutti inclusi):
A 5 anni: PFS 75%, OS 80% |
Criteri (tutti inclusi):
A 5 anni: DFS 67%, OS 72% |
| Cattiva | Criteri (almeno uno):
A 5 anni: PFS 41%, OS 48% |
Nessun paziente classificato a cattiva prognos |
| PFS: sopravvivenza libera da progressione; OS: sopravvivenza globale; ULNR: limite superiore di normalità |
||
Bibliografia
- Puc HS, Scheinfeld J. Management of residual mass in advanced seminoma: results and recommendations from the Memorial Sloan-Kettering Cancer Center. J Clin Oncol 1996, 14: 454-60.
- Haugnes HS, Laurell A, Stierner U, et al. High-dose chemotherapy with autologous stem cell support in patients with metastatic non-seminomatous testicular cancer – a report from the Swedish Norwegian Testicular Cancer Group (SWENOTECA). Acta Oncol 2012, 51: 168-76.
- Fizazi K, Culine S, Kramar A, et al. Early predicted time to normalization of tumor markers predicts outcome in poor-prognosis non seminomatous germ cell tumors. J Clin Oncol 2004, 22: 3868-76.
- Oyen RH. Scrotal ultrasound. Eur Radiol 2002, 12: 19-34.
- Ellis JH, Blies JR, Kopecky KK, et al. Comparison of NMR and CT imaging in the evaluation of metastatic retroperitoneal lymphadenopathy from testicular carcinoma. J Comput Assist Tomogr 1984, 8: 709-19.
- Sohaib SA, Koh DM, Barbachano Y, et al. Prospective assessment of MRI for imaging retroperitoneal metastases from testicular germ cell tumours. Clin Radiol 2009, 64: 362-7.
- See WA, Hoxie L. Chest staging in testis cancer patients: imaging modality selection based upon risk assessment as determined by abdominal computerized tomography scan results. J Urol 1993, 150: 874-8.
- de Wit M, Brenner W, Hartmann M, et al. [18F]-FDG-PET in clinical stage I/II non-seminomatous germ cell tumours: results of the German multicentre trial. Ann Oncol 2008, 19: 1619-23.
- Huddart RA, O’Doherty MJ, Padhani A, et al. NCRI Testis Tumour Clinical Study Group. 18Fluorodeoxyglucose positron emission tomography in the prediction of relapse in patients with high risk, clinical stage I non seminomatous germ cell tumors: preliminary report of MRC Trial TE22—the NCRI Testis Tumour Clinical Study Group. J Clin Oncol 2007, 25: 3090-5.
- Cremerius U, Wildberger JE, Borchers H, et al. Does positron emission tomography using 18-fluoro-2-deoxyglucose improve clinical staging of testicular cancer?- Results of a study in 50 patients. Urology 1999, 54: 900-4.
- Albers P, Bender H, Yilmaz H, et al. Positron emission tomography in the clinical staging of patients with Stage I and II testicular germ cell tumours. Urology 1999, 53: 808-11.
- Sobin LH, Gospodariwicz M, Wittekind C (eds). TNM classification of malignant tumors. UICC International Union Against Cancer, 7th edition. Wiley-Blackwell, 2009: pp 249-54.